

6月28日,陕西省药监局发布了一则关于印发2020年陕西省重新发放药品生产许可证和医疗机构制剂许可证工作方案的通知。
此次制定的工作方案中主要是针对要重新发证的企业和医疗机构范围和所要准备的工作进行明确的规定。
重新发证范围:(一)省内依法持有《药品生产许可证》,且有效期至2020年12月31日,需要继续生产药品的药品生产企业;
(二)省内依法持有《医疗机构制剂许可证》,且有效期至2020年12月31日,需要继续配制制剂的医疗机构。
《药品生产许可证》和《医疗机构制剂许可证》在2020年12月31日以后到期的,应在有效期届满前6个月申请重新发证,参照本方案执行。
值得注意的是:要重新发证的辖区内的中成药、化学药、生物制品等制剂生产企业要在2020年7月30日前完成自查工作,具体实际的要求如下:
1.《药品生产许可证》重新发放申请报告。报告中应明确重新发证前生产地址和生产范围及拟重新发证的生产地址和生产范围;生产范围应当按照《中华人民共和国药典》制剂通则及其他的国家药品标准等要求填写,并注明各剂型范围所在车间(实行编号管理,标注各车间序号)和生产线、《药品生产许可证申请表》(附件4)。
3、《药品生产许可证》《营业执照》全本复印件和各剂型最后一次的药品GMP证书或药品GMP符合性检查结果通知书。
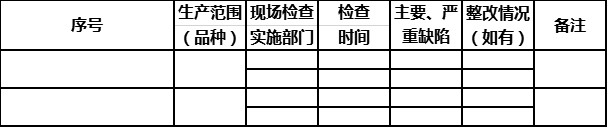
4.各生产范围(品种)近两年接受各类监督检查的明细表及检查证明材料复印件(检查报告应加盖公章),原料药、生物制品须具体到品种名称。
(1)企业概述。包括企业历史沿革、各生产范围五年以来生产和质量管理情况、停产的生产范围及相对应的生产车间和生产线)五年以来关键岗位人员及关键生产设施设备等条件发生明显的变化的情况;
(5)品、和药品类易制毒化学品生产企业应在申请表备注栏内注明,并同时提交相应品种定点生产批件,及其安全管理情况、有一定的问题和改进措施的自查报告。
6.企业旁边的环境图、总平面布置图(实行编号管理,标注各车间序号)、仓储平面布置图、质量检验场所平面布置图;
7.生产工艺布局平面图(包括更衣室、盥洗间、人流和物流通道、气闸等,并标明人、物流向和空气洁净度等级),空气净化系统的送风、回风、排风平面布置图,工艺设备平面布置图;
8.各市(区)市场监督管理局(药监分局)或省局药品生产处出具的重新发证审核意见表,如有现场检查,应附现场检查报告和企业整改报告。
10.凡申请企业申报材料时,申请人不是法定代表人或负责人本人,企业应当提交《授权委托书》。
申报资料应按申请材料顺序制作目录,内容应真实、完整、清晰。材料规格统一用A4纸规格,如有特殊情况,如:图表类,可用A3纸规格。需提交复印件的,应在复印件上注明“此复印件与原件相符”字样,资料应按要求签字并加盖企业红章。
(1)制剂室和各配制范围五年来配制质量管理情况概述、有一定的问题、风险分析及改进措施;
(2)五年以来已经停产的配制范围、停产时间、停产原因、生产条件改变情况、未来计划等;
(3)五年以来接受各级药品监管部门监督检查、有一定的问题及整改落实情况,其中近两年检查与整改情况应当详述;
(4)五年以来不合格制剂被国家和省(市、区)药监管理部门质量公告通告情况及整改情况;
11.各市(区)市场监督管理局(药监分局)出具的重新发证审核意见表,如有现场检查,应附现场检查报告和医疗机构整改报告。
申报材料时,应同时提交申请材料真实性保证声明,申请人不是法定代表人或负责人本人的,还应提交《授权委托书》,申报资料应按目录装订成册,复印件加盖单位公章。
药监局有关部门在审批前进行全方位检查工作,原《药品GMP证书》有效期至2020年7月1日之后,或近两年通过药品GMP符合性检查的药品生产企业;自2019年1月1日起至申报之日接受陕西省医疗机构制剂配制专项检查且整改到位的医疗机构,原则上可免于现场检查。其中必须要格外注意的是有这些情形的将进行现场检查:
(3)原《药品GMP证书》于2020年6月30日前到期,且未接受药品GMP认证或GMP符合性检查的(含检查未通过的);
(4)根据风险管理原则,资料审核单位认为其他有必要进行现场检查的。存在下列4中情形的将不予重新发放《药品生产许可证》《医疗机构制剂许可证》:
1.实际已不具备生产条件的药品生产企业(或生产范围)、医疗机构制剂室(或配制范围);
2.经现场检查,不具备药品生产条件、制剂配制条件,或存在严重生产质量隐患,且无法整改或整改未达到一定的要求的药品生产企业(或生产范围)、医疗机构制剂室(或配制范围);
平台声明:该文观点仅代表作者本人,搜狐号系信息发布平台,搜狐仅提供信息存储空间服务。
手机:18822972172(微信同号)
价格优惠,开云体育在线登录入口欢迎致电咨询!
地址:东莞市寮步镇向西村工业区村口街3号厂房